中國自研“數字心臟”:模擬速度提升180倍
鳳凰科技 2024-11-29 01:37:23 1
心臟,作為重要器官之一,其功能正常與否直接影響人類的生命延續。電生理特性反映了心臟的健康和疾病狀態。心臟電生理活動的異常,往往會導致心律失常,從而引至心臟泵血功能衰竭等嚴重健康問題。因此,深入理解和研究心臟的電生理過程,對於提高心臟病的診斷和治療水平至關重要。
傳統的心臟電生理研究多依賴於實驗室內的動物模型和臨床資料,但這類方法往往受限於倫理問題、實驗條件和資料獲取的複雜性。隨著計算技術的發展,計算機模擬成為了一種新興且強大的研究工具。透過建立數學模型和計算機程式,研究人員可構建數字孿生心臟,能夠在虛擬環境中模擬並重現心臟器官的電生理活動(虛擬生理心臟),分析其動態特性,並進行不同生理與病理條件下的實驗。
虛擬心臟電生理模擬對計算資源要求極高,即使是幾毫秒的模擬,也需要累積求解數十億次微分方程。使用複雜的虛擬心臟模型進行研究時,重現1秒鐘的心臟電活動也可能需要數小時或更長。這給虛擬生理心臟的臨床應用與藥物研發帶來重大挑戰。
為解決這一問題,智源研究院開發了一套實時心臟電生理模擬系統。該系統不僅能夠實時模擬心臟的3D電活動,還能透過多種引數的調節,深入探討不同生理、病理因素對心臟功能的影響。
這一實時心臟模擬平臺,一方面可在醫學基礎研究領域發揮作用,幫助臨床醫生和研究人員更直觀地理解心臟的電生理過程,探究心律失常產生機制、預測猝死發生率等;另一方面,可用於構建虛擬藥物安全性評估平臺,對推動藥物安全評估發展具有重要意義;更重要的是,可以在臨床應用中提供手術方案預演與決策支援,比如射頻消融方案規劃,心臟起搏器最佳植入方案規劃等。該技術的推進將為醫學研究和臨床治療提供新的正規化。
1
虛擬心臟模擬發展史
虛擬生理心臟的構建可利用生理組學的研究方法,綜合分子生物學、生物化學、生理學、解剖學及臨床醫學的最新成果,數學化以及模式化地整合從基因、蛋白質、細胞、組織到器官的解剖(多物理尺度:空間尺度跨越10^9量級,跨時間尺度:時間尺度跨越10^15量級,如圖1所示)、生理和生化資訊,應用計算機強有力的計算和圖形顯示能力,透過賦予其心臟所具有的動力學特性、生化特性和各種生理病理特點,使之從形態、結構和功能等方面逼真地再現心臟的生理和病理活動過程。
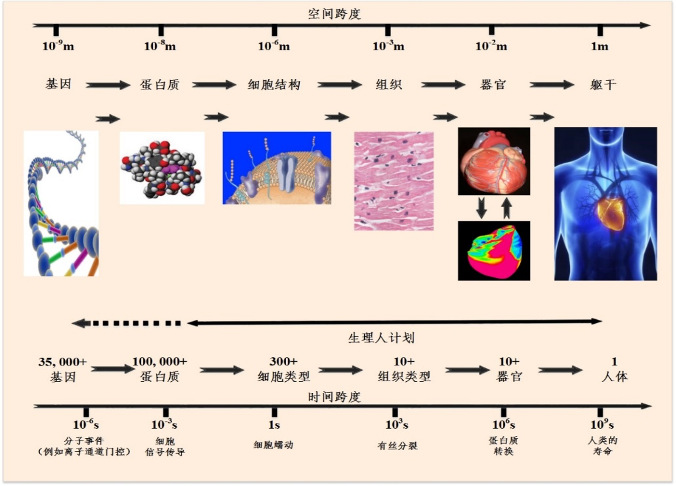
圖注1:構建虛擬生化生理人體的時間和空間尺度。時間尺度橫跨由分子事件(µs)、細胞訊號傳導(ms)、細胞功能(s)到人體壽命 (decades) 的10^15跨度。空間尺度橫跨由分子(nm)、細胞(µm)、器官(cm)到軀幹 (m) 的10^9跨越。
虛擬生理心臟研究可追溯與上世紀五十年代。1952年諾貝爾獎得主Hodgkin和Huxley建立了世界上第一個細胞計算模型 — 烏賊神經元細胞模型[1],開創了用計算模型研究生物問題的先河。1960年Denis Noble[2]在Nature雜誌上發表了第一個心肌細胞計算模型 — 浦肯野心肌細胞模型,開創虛擬生理心臟模型的先例。此後幾十年的研究中,不斷有研究人員研發針對不同物種、心臟不同組織、複雜精密的心肌細胞電生理模型[3]。1991年,Peter Hunter等人[4]基於犬實驗資料構建了第一個心臟解剖結構模型,融合多物理尺度與電生理的虛擬心臟模型研究進入新階段。此後,多尺度、多物理模態的心臟計算模型陸續出現,並被成功應用於心臟功能研究與藥物安全性評估[5-8]。
在早期虛擬生理心臟研究中,心臟一個生物秒的電生理活動往往需要數日甚至數月來模擬計算。隨著視訊記憶體技術的發展,這個時間縮短到數天。近年,有研究致力於提升虛擬生理心臟的計算速度。比如透過將三維心臟空間劃分為矩形子區域來實現並行心臟模擬[9],使運算速度大大提升。另一項研究透過WebGL將高效能心臟模擬擴充套件到普通計算機上[10],甚至有GPU的手機也可以模擬三維心室的電動態。一些研究試圖透過自適應時間步長來提高執行速度[11,12],結果表明,固定時間步長比自適應時間步長方法具有更好的效率[11]。
但這些研究僅能達到“準實時運算”,離真正意義上的“實時運算”,即模擬時間與生物時間比達到1:1,還有難以逾越的距離,更不用說模擬精度的提升帶來的運算量爆炸式增長。高計算複雜度帶來的海量運算,使得虛擬生理心臟模型難以實現實時計算,阻礙其大規模應用。
2
實時計算
為了在更高解析度、更高精度和更大規模的心臟模型上實現實時模擬,智源研究院開發了具有精細細胞電生理與解剖結構的人心室模型。該模型包含了19種細胞生理狀態變數和70多個公式,能夠實現複雜的心臟電生理與病理模擬,為臨床與醫藥工業應用提供豐富的場景。
為實現實時計算,智源對模型底層計算進行了深度最佳化。針對心臟模擬中計算強度大和I/O密集等瓶頸問題,智源充分結合A100平臺的硬體特點,設計了多種最佳化策略,如量化和迴圈展開。這些措施有效降低了計算複雜度和I/O,使得在更大規模和更高複雜度的心臟模型上實現了180倍的速度提升。
最終,智源虛擬心臟模擬系統實現了對心臟電生理功能的實時模擬,達到生物時間與計算時間比為1:0.84。這一成果不僅提升了心臟模擬系統的效能,還為更廣泛的醫學研究和臨床應用提供了強有力的支援,標誌著心臟模擬技術的又一重大里程碑進展。
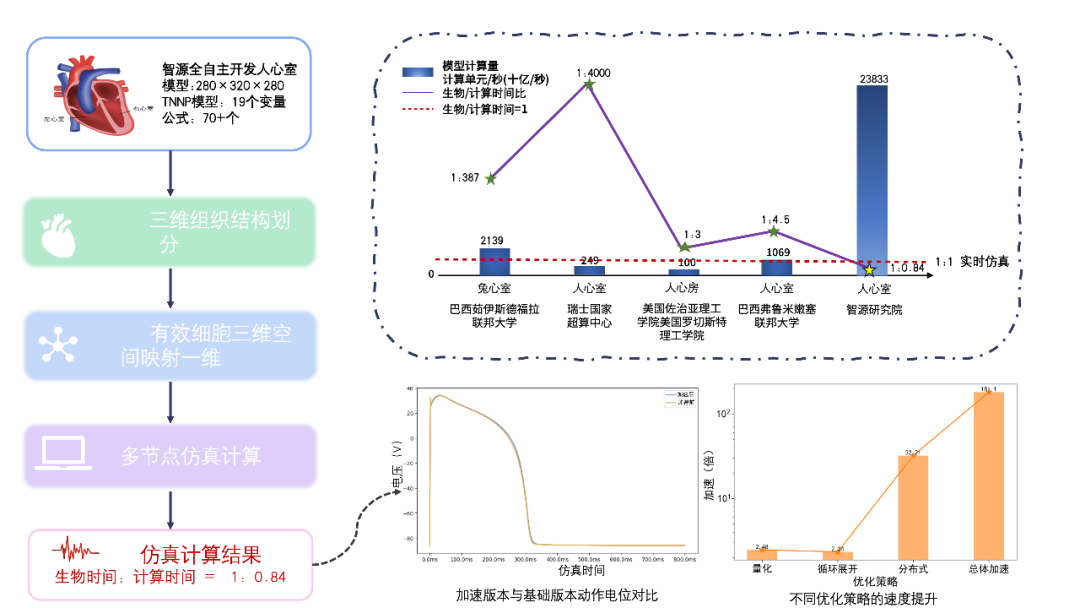
圖注2:實時心臟計算概覽圖
2.1 技術路線
在GPU的架構設計中,順序訪問記憶體(如連續的資料訪問)相較於隨機訪問具有更高的效能。此外,在執行順序訪問時,通常會採用預取技術提前載入資料,以進一步提高訪問效率。
同時,在虛擬心臟模型中,大約有2/3的物理空間位置是空餘腔體空間,有效心肌組織僅佔1/3的物理空間。心臟模擬的主要計算和I/O操作都集中在對有效心肌組織中的每一個單細胞中的離子通道和細胞膜電位進行時間上的精細更新,同時考慮鄰近細胞的電耦合影響。
基於GPU訪存特點和心臟解剖結構的特殊性,我們設計了適合稀疏資料的資料結構。利用順序訪存提升I/O速度,確保並行執行緒僅處理有效細胞,從而最大限度地提高GPU記憶體的利用率。透過這種創新的結構,顯著最佳化了計算效能,使得心臟模擬能夠在IO訪存上達到最優效果。
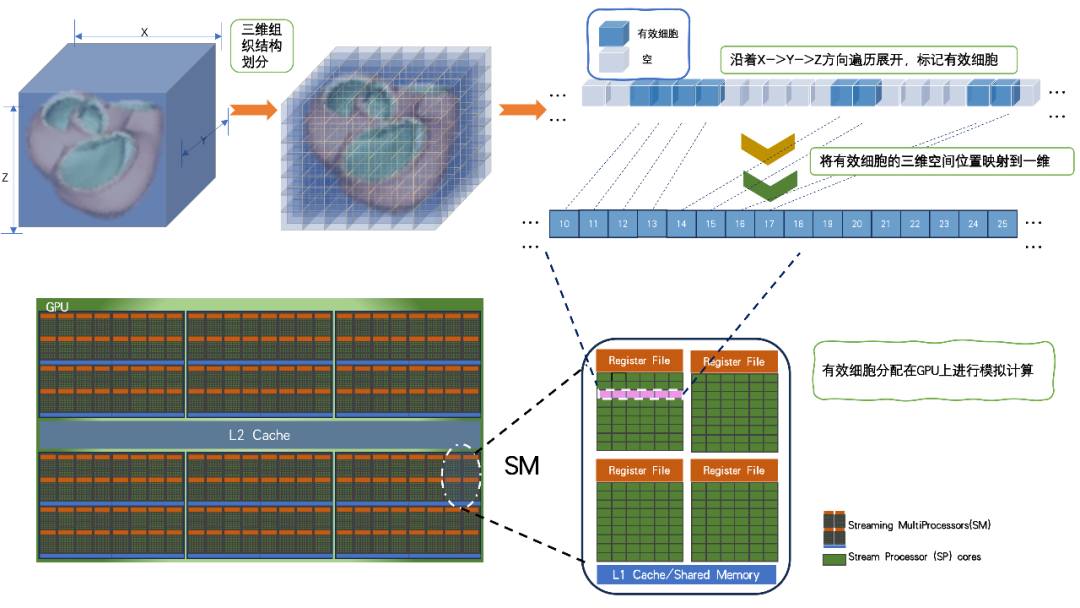
圖注3:心臟模型有效資料在GPU記憶體上的排布
在計算層面,採用量化策略,有效簡化模型中的對數和指數等複雜計算,從而顯著降低了計算複雜度。
此外,為進一步減少I/O操作次數,採用迴圈展開策略,實現在一次讀取中進行多次計算,大大降低I/O,顯著提升SM核心的計算利用率。
基於A100平臺,我們設計了高效的P2P通訊方式,利用GPU直連實現在節點內快速的資料交換,確保資料傳輸的低延遲與高頻寬。在節點之間,採用RDMA(遠端直接記憶體訪問),進一步增強跨節點資料傳輸的效率,充分發揮硬體平臺的平行計算與通訊能力。
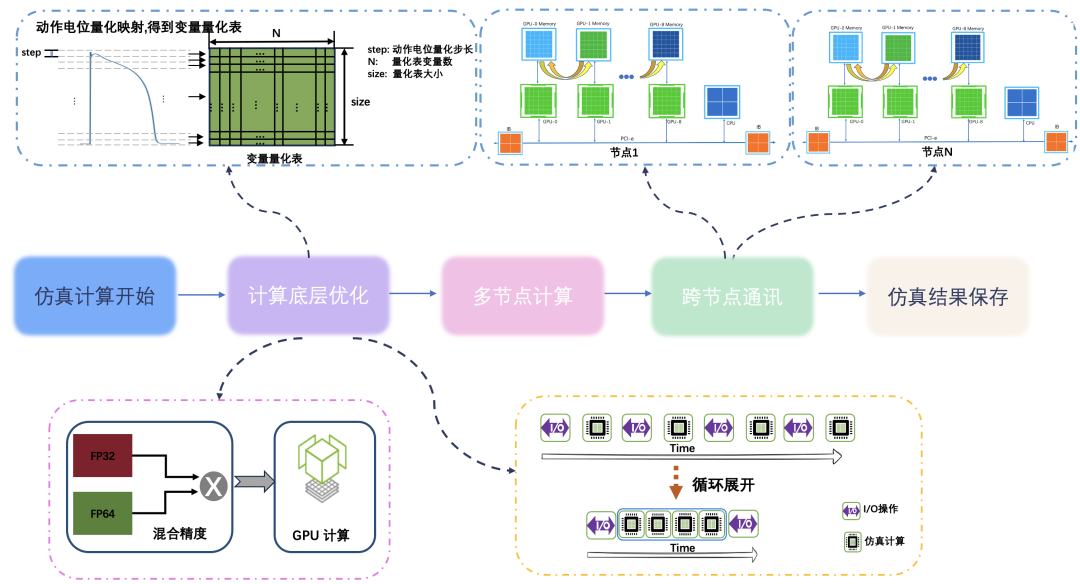
圖注4:技術路線圖
2.2 模擬結果
我們測試了不同最佳化策略對模擬2生物秒心臟功能所用計算時間的影響,結果如下圖所示。對2生物秒心臟功能的模擬,基準模型在未最佳化的情況下A100單卡需要計算時間為304.25秒。在採用分散式、量化、迴圈展開策略後,其所用時間分別是9.75、3.93、1.68秒。其中採用迴圈展開後,計算時間達到2秒內,達到計算時間/生物比小於1,實現實時/超實時計算的要求。其中,分散式計算對於系統模擬速度影響最大,達到了32倍提速。量化策略和迴圈展開策略分別將模擬速度提升了2.48和2.34倍。在同時採用分散式、量化、迴圈展開策略的情況下,系統模擬速度整體提升了181倍。
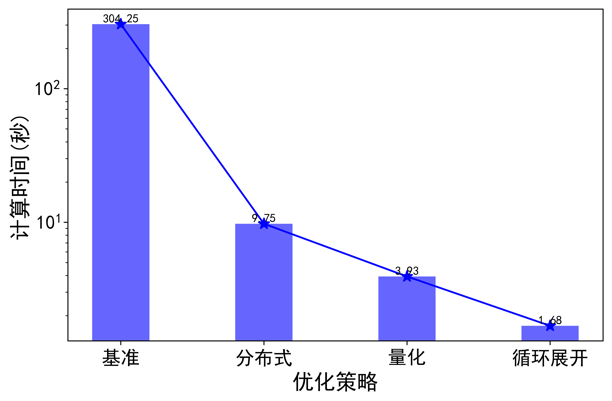
圖注5:不同最佳化策略的計算時間
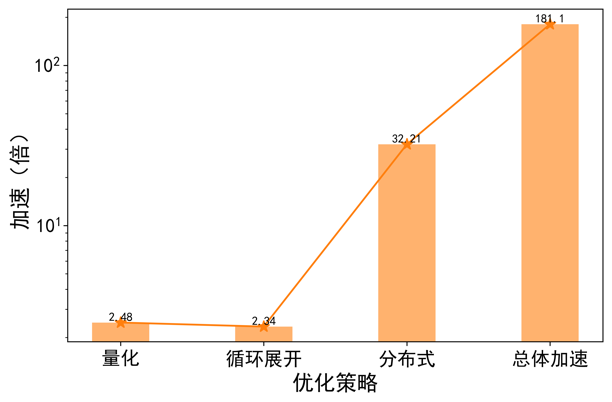
圖注6:不同最佳化策略的速度提升
2.2.1 拓展曲線
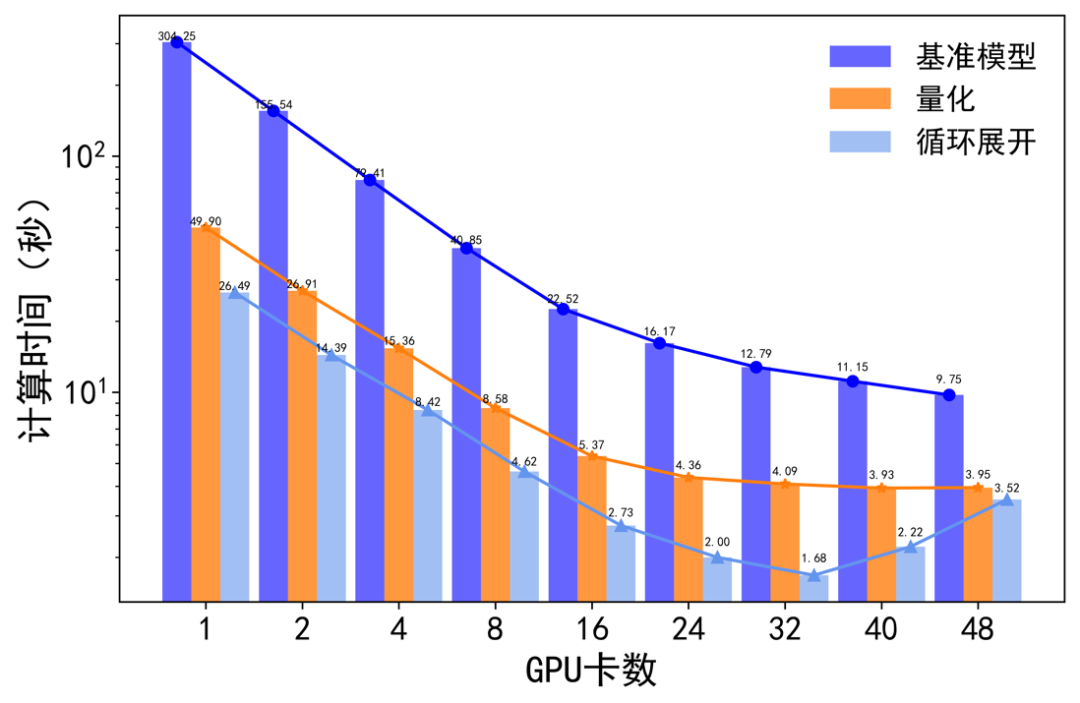
圖注7:不同最佳化策略的拓展曲線
如圖7擴充套件曲線所示,隨著GPU卡數的增加,基準模型和最佳化後的模型模擬時間都在減少。基準模型在增加到48卡後,計算時間不再減小。此時的生物:計算時間比為1:5。再採用量化和迴圈展開策略後,32張卡即可實現實時計算,生物:計算時間比達到1:0.84。
2.2.2 主要GPU指標
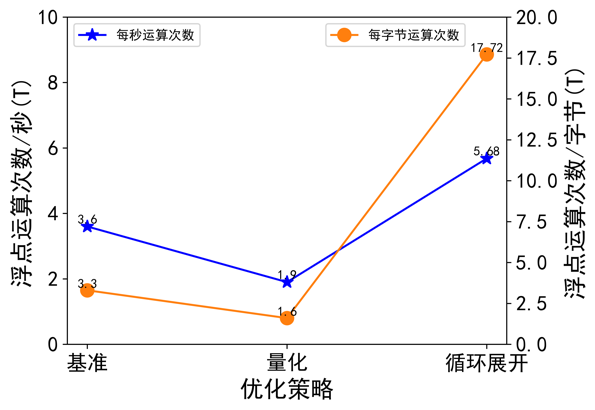
圖注8:不同最佳化策略的計算密度和計算強度
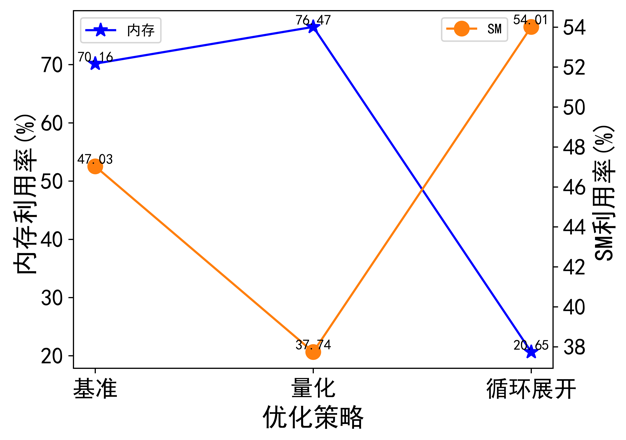
圖注9:不同最佳化策略的記憶體和SM利用率
透過GPU指標可以看出(圖8,圖9)量化策略透過提升IO同時降低計算的方式提高整體計算效能;迴圈展開透過大幅度降低I/O同時提高計算密度的方式提高計算效能。
2.2.3 計算精度
我們統計了加速前與加速後的結果誤差,模擬的膜電位V的時程差別
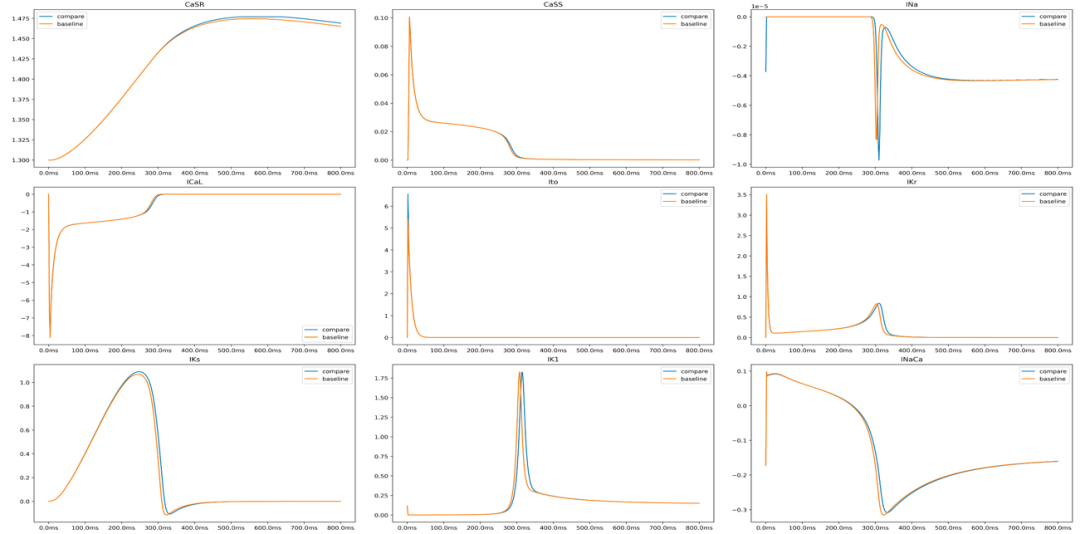
圖注10:模擬前後細胞主要離子通道電流與胞內離子濃度在一心律節拍間的變化
3
總結
智源研究院從心臟模型的解剖結構、心肌細胞電生理的計算特點及計算系統的硬體架構出發,設計了心臟模擬系統的資料結構和最佳化策略,以提高計算效率。我們採用先進的並行處理方法,充分利用現代GPU裝置的強大計算能力,最佳化資料傳輸和通訊方式,以減少延遲並提高資料吞吐量。透過這些策略,不僅提升了模擬系統的計算速度,還保證了在可接受誤差範圍內的計算精度,最終成功實現了心臟模擬的實時計算目標,達到超實時計算結果。這一成果為進一步研究心律失常產生的離子通道與分子機制等關鍵醫學問題,也為手術規劃如房顫射頻消融方案等臨床應用,以及新藥研發與其心臟安全性篩選奠定了堅實基礎,同時也為其它超大複雜物理系統的實時模擬提供堅實基礎。
相關文章
- 中國自研“數字心臟”:模擬速度提升180倍
- 斯諾克英錦賽16強誕生,中國軍團佔據3席,16進8輪次對陣出爐
- 斯諾克大冷門!NO.6剛奪冠就1輪遊,75三傑剩獨苗,中國3人進16強
- 斯諾克英錦賽最新戰報:16強出爐!中國球員佔3席,張安達轟出147
- 人類第一次!中國天問三號2031年前後採集火星樣品返回
- 中國電信沙特公司在利雅得正式成立,已於全球53個國家和地區設立分支機構
- 中國自主研製的首艘新型大型LNG運輸船交付:打破海外壟斷,填補國內空白
- 贏了0.37秒!21歲中國姑娘創造歷史,中國隊終於實現“零的突破”
- 中國力量閃耀UFC格鬥之夜 張名揚一肘OK對手 閆曉楠喊話張偉麗
- 中國男籃90-52大勝蒙古,胡金秋11中10得20分,胡明軒14+4
